miR-34a-5p靶向Smad4抑制子宫内膜纤维化的机制研究*
来源:优秀文章 发布时间:2022-12-07 点击:
范李静,张 苗,郑瑛红,刘文杰,范小斌
(西北大学附属医院西安市第三医院妇产科,西安 710021)
宫腔粘连(intrauterine adhesions,IUAs),也称为Asherman综合征,是一种子宫疾病,其特征是子宫内膜受损,盆腔或宫内发生疤痕和粘连[1]。宫腔粘连是宫内手术或子宫内膜感染、产后子宫内膜炎有关的并发症[2]。宫腔粘连发生的主要原因是细胞外基质生成和降解异常,细胞外基质过度的堆积导致子宫内膜纤维化进一步形成瘢痕发生宫腔粘连。转化生长因子-β1(transforming growth factor β1,TGF-β1)是一种较强的促纤维化因子,与创面的修复愈合有关,高表达的TGF-β1对纤维疤痕组织的形成有促进作用。TGF-β1激活后,可与其受体结合并激活下游Smad信号,包括Smad2和Smad3,使其组织发生纤维化[3]。已有相关研究表明,TGF-β1/Smad信号通路参与宫内粘连[3]。MicroRNAs(miRNAs)是一种小的、内源性的、非编码的、由18~22个核苷酸组成的单一RNA分子,通过直接结合其靶基因的3"-UTR调控基因表达[4]。越来越多的证据表明,miRNAs的失调参与了宫腔粘连。宫腔粘连小鼠的子宫内膜中miR-1291水平显著升高[5]。miR-34a-5p具有促细胞凋亡和抗细胞增殖的能力[6]。miR-34a-5p在纤维化疾病肝硬化中表达降低,人肝星状细胞中过度表达miR-34a-5p通过靶向Smad4和调节TGF-β1/Smad3途径可以改善肝纤维化的发展[7]。而miR-34a-5p在宫腔粘连纤维化疾病中的研究未见相关研究报道。基于此,本文拟研究miR-34a-5p在子宫内膜纤维化中的作用,并探讨其可能机制。
1.1 研究对象 选取2020年10月至2021年6月于西安市第三人民医院妇产科行宫腔镜检查并确诊为宫腔黏连的患者20例,年龄30~45岁。纳入标准:经宫腔检查符合宫腔粘连的诊断。排除标准:合并妇科恶性肿瘤、不典型增生;
合并生殖道和泌尿道急性感染。选取同期行宫腔镜检查的非宫腔黏连患者20例(因子宫纵膈、不孕或节育器嵌顿)作为对照组,年龄21~35岁。本研究经医院伦理委员会批准。
1.2 主要试剂、仪器 人子宫内膜间质细胞(human endometrial stromal cell,hESC,CL0453)购自湖南丰晖生物;
psiCHECK-2质粒购自美国Promega;
胎牛血清、双抗购自Hyclone;
MEM+NEAA培养基(PM150410)购自武汉普诺赛;
TGF-β1(10804-HNAC)购自北京义翘神州;
miR-34a-5p mimics和pcDNA3.1-Smad4过表达质粒购自上海吉玛基因;
X-tremeGENE siRNA Transfection Reagent(04476093001)、FastStart Essential DNA Green Master(06924204001)购自美国Roche公司;
psiCHECK-2-WT-Smad4、psiCHECK-2-MUT-Smad4质粒合成于北京擎科生物;
RevertAid First Strand cDNA Synthesis Kit(K1622)购自美国Thermo;
α-平滑肌肌动蛋白(α-SMA)抗体(ab5831)、胶原蛋白Ⅰ(collagen I,COL1A1)抗体(ab138492)、纤维连接蛋白(Fibronectin,FN)抗体(ab45688)和Smad4抗体购自英国Abcam;
细胞增殖与毒性检测试剂盒(C008-3)、Annexin V-FITC/PI双染法细胞凋亡检测试剂盒(A005-3)购自上海七海复泰。
1.3 实验方法
1.3.1 hESC细胞的培养及诱导 hESC细胞培养于含10%胎牛血清的完全培养基(MEM+NEAA+1%双抗),5% CO2、37℃恒温培养箱。取对数生长期hESC细胞,0.25%胰蛋白酶消化后重悬,调整细胞浓度,按3×105细胞/孔铺至6孔板。待细胞贴壁,更换成含5%血清的培养基,分别加5ng/mL和10ng/mL的TGF-β1处理细胞24h和48h,每个浓度设置3个重复孔。
1.3.2 miR-34a-5p mimics转染hESC细胞 将hESC细胞按5×104细胞/孔铺至24孔板,待细胞汇合度为40%左右时每孔加50pmol/L miR-34a-5p mimics或mimics NC,经X-treme GENE siRNA Transfection Reagent转染24h,检测miR-34a-5p表达以验证转染效率。细胞分组:Control组:未处理的正常hESC细胞;
TGF-β1组:10ng/mL TGF-β1处理hESC细胞;
mimics NC组:hESC细胞转染mimics NC后经10ng/mL TGF-β1处理;
miR-34a-5p mimics组:hESC细胞转染miR-34a-5p mimics后经10ng/mL TGF-β1处理。
1.3.3 CCK-8检测细胞增殖 根据细胞增殖与毒性检测试剂盒使用说明书,将对数生长期hESC细胞用0.25%胰蛋白酶消化并接种至96孔板。经特定处理后,每孔加100 μL 7Sea-Cell Counting Kit溶液,置于细胞培养箱继续孵育1h,酶标仪测定每孔在450nm处的吸光值。
1.3.4 miR-34a-5p靶基因预测 利用miRanda、TargetScan及PicTar数据库预测miR-34a-5p的潜在靶基因并取其交集。利用David网站对得到的188个靶基因进行KEGG通路分析,并筛选miR-34a-5p的靶基因。
1.3.5 双荧光素酶报告基因实验 经生物信息学分析,初步筛选Smad4为miR-34a-5p的靶基因;
将包含miR-34a-5p结合序列的psiCHECK-2-Smad4野生质粒(psiCHECK-2-Smad4-wt)及psiCHECK-2-Smad4突变质粒(psiCHECK-2-Smad4-mut)分别与miR-34a-5p mimics和mimics NC用Lipofectamine 2000脂质体共转染入人胚肾细胞HEK-293T。
48h后,用Dual-Luciferase Reporter Assay System试剂盒检测Smad4的荧光强度,验证miR-34a-5p和Smad4之间的靶向关系。
1.3.6 Smad4过表达质粒转染 分离、纯化并扩增Smad4的基因片段,与pCDNA3.1连接(pCDNA3.1-Smad4),空质粒载体pCDNA3.1-vector作为阴性对照。将pCDNA3.1-Smad4和pCDNA3.1-vector用Lipofectamine 2000分别转染入hESC细胞,孵育48h后检测Smad4表达以验证转染效率。将miR-34a-5p mimics和Smad4过表达质粒共转染至hESC细胞,TGF-β1处理24h检测hESC细胞的增殖情况和纤维化情况。
1.3.7 实时定量PCR hESC细胞和经研磨处理的子宫内膜组织经TRizol裂解液裂解提取样本的RNA。Nanodrop分光光度计测定RNA浓度。Thermo Revert Aid First Strand cDNA Synthesis Kit试剂盒进行实时定量PCR(quantitative real-time PCR,qRT-PCR)检测。反应条件:95℃,300s;
95℃,5s,60℃,30s,循环次数为45次。
1.3.8 Western blot检测 将收集的细胞加适量体积的RIPA裂解液并收集上清。BCA法测定总蛋白浓度。准备好样品,用微量进样器上样,每孔上样量20μg蛋白,使用恒压80V电泳。电转至PVDF膜(电流200mA转膜2h),5%脱脂奶粉室温摇床孵育封闭1h。PVDF膜加入α-SMA、fibronectin和COL1A一抗, 4℃摇床过夜孵育。将膜置于二抗稀释液,室温摇床孵育1h。加入ECL蛋白发光液观察蛋白条带,使用Image-Pro Plus 6.0软件进行灰度值分析。
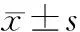
2.1 miR-34a-5p在宫腔粘连内膜组织及TGF-β1处理后hESC细胞中的表达 qRT-PCR检测结果显示,与未粘连组[1.38(0.65,2.05)]相比,粘连组的miR-34a-5p表达水平[0.74(0.42,1.01)]显著降低(Z=-2.218,P=0.027)。10ng/mL TGF-β1分别处理hESC细胞24、48h后,细胞中miR-34a-5p表达水平显著降低(P<0.01)。后续均用10ng/mL TGF-β1处理hESC细胞24h。见图1。
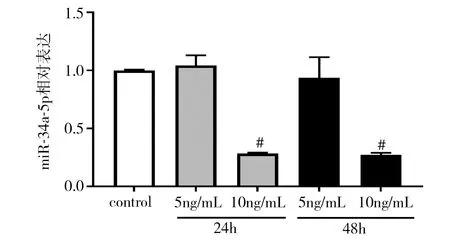
图1 TGF-β1处理的hESC细胞中miR-34a-5p表达水平#P<0.01 vs control组
2.2 miR-34a-5p对TGF-β1诱导hESC增殖和细胞形态的影响 CCK-8结果显示,TGF-β1组hESC细胞增殖显著高于对照组[(114.1±0.94)% vs (100 ±0.76)%,P= 0.003];
与mimics NC组相比,miR-34a-5p mimics组细胞增殖显著下降[(113.8±1.1)% vs (105.4± 0.5)%,P=0.001]。Control组细胞形态呈圆形或卵圆形,胞间连接紧密。TGF-β1诱导后细胞形态出现明显改变,细胞多为长梭形,细胞间隙较大。miR-34a-5p mimics组细胞形态与Control组相似,多为圆形或卵圆形(图2)。

图2 miR-34a-5p对TGF-β1诱导的hESC细胞形态的影响A:Control;B:TGF-β1;C:TGF-β1+mimics NC;D:TGF-β1+ miR-34a-5p mimics
2.3 miR-34a-5p对TGF-β1诱导hESC纤维化的影响 qRT-PCR和Western blot结果显示,与Control组相比,TGF-β1组纤维化标志物α-SMA、fibronectin和COL1A1显著升高(P<0.05),miR-34a-5p mimics组的α-SMA、fibronectin和COL1A1表达显著低于mimics NC组(P<0.05)。见图3。提示miR-34a-5p对TGF-β1诱导的hESC纤维化有抑制作用。

图3 miR-34a-5p对TGF-β1诱导hESC纤维化的影响A~C:qRT-PCR检测hESC细胞中α-SMA、fibronectin和COL1A1的mRNA的表达水平;
D~G:Western blot法检测hESC细胞中α-SMA、fibronectin和COL1A1蛋白表达水平;*P<0.05;1:control;2:TGF-β1;3:TGF-β1+NC;4:TGF-β1+miR-34a-5p mimics
2.4 Smad4是miR-34a-5p的靶基因 David网站分析显示,miR-34a-5p的靶基因主要分布于TGF-β 通路,这些靶基因主要包括Smad4、p70S6k等。Smad4作为TGF-β的激活分子是miR-34a-5p的一个靶基因(图4A)。双荧光素酶报告基因结果表明,与阴性对照组比较,miR-34a-5p可显著抑制Smad4 3"-UTR野生型的报告基因活性,而对Smad4 3"-UTR突变型的报告基因活性没有影响(图4A)。表明miR-34a-5p可作用于Smad4的3"-UTR区。Western blot结果表明,miR-34a-5p过表达可显著下调Smad4蛋白的表达水平(图4B)。

图4 Smad4是miR-34a-5p的靶基因A:双荧光素酶报告系统检测转染不同质粒hESC细胞中的荧光强度;
B:Western blot法检测过表达miR-34a-5p后Smad4表达水平;
*P<0.05
2.5 Smad4参与miR-34a-5p的抗增殖、抗纤维化作用 与空载体对照处理的hESC相比,Smad4过表达质粒转染hESC细胞后Smad4表达水平升高2.3倍(P=0.004)。见图5A、B。过表达Smad4后,hESC细胞活力显著升高(图5C)。与共转染miR-34a-5p和空载对照的hESC细胞相比,共转染miR-34a-5p和Smad4过表达质粒的hESC细胞内α-SMA(P=0.01)和COL1A1(P<0.01)mRNA和蛋白表达水平均显著升高(图5D~H)。

图5 Smad4参与miR-34a-5p对TGF-β1诱导hESC细胞增殖和纤维化作用的抑制A、B:Smad4过表达效率检测;
C:CCK-8检测各组hESC细胞活力;
D、E:qRT-PCR检测各组hESC细胞α-SMA和COL1A1 mRNA表达量;
F:Western blot法检测hESC细胞中α-SMA和COL1A1蛋白表达水平;
G、H:hESC细胞中α-SMA和COL1A1蛋白相对定量水平。*P<0.05;
#P<0.05;1:miR-34a-5p mimics;2:miR-34a-5p mimics+Scramble;3:miR-34a-5p mimics+Smad4
宫腔粘连是育龄妇女最常见的疾病之一,中度至重度宫腔粘连患者正常月经模式减少、闭经甚至不孕,对患者的身心健康产生不利影响。TGF-β在宫腔粘连的形成中起重要作用,宫腔粘连患者子宫内膜中TGF-β蛋白水平显著升高,促进子宫内膜发生纤维化[8]。
miRNAs在纤维化的调节中起着决定性的作用。miR-326在宫腔粘连患者子宫内膜组织中下调,miR-326通过调节TGF-β1/Smad3通路抑制子宫内膜纤维化[9]。miR-543通过抑制子宫内膜细胞的增殖、迁移和侵袭,抑制宫腔粘连的发生和发展[10]。本研究发现,宫腔粘连内膜组织中miR-34a-5p表达量降低。miR-34家族具有强大的促细胞凋亡和抗细胞增殖的作用[6]。miR-34a-5p参与肾小管间质纤维化及肝脏纤维化等多种纤维化疾病[7,11]。目前miR-34a-5p是否影响宫腔粘连纤维化还未见研究报道。本研究发现,miR-34a-5p参与hESC细胞的纤维化,miR-34a-5p表达增加可降低hESC细胞的纤维化进程。这与Zhang等[12]研究结果相似,即miR-34a可通过减少I型胶原蛋白的产生以及通过靶向Pin-1信号传导减轻糖尿病性心肌病的心肌纤维化。但也有研究发现,miR-34a促进肝星状细胞及肾小球系膜细胞纤维化[13-14]。上述结果的差异可能与细胞及疾病种类相关。
Smad4表达失调与多种人类疾病有关,如组织纤维化、炎症和癌变,提示Smad4在治疗这些疾病方面具有治疗潜力[15]。本研究利用miRanda、TargetScan、Pictar数据库预测了miR-34a-5p的潜在靶基因,预测Smad4的3"UTR区和miR-34a-5p可能有结合位点;
使用双荧光素酶报告验证确定Smad4的3"UTR区和miR-34a-5p有结合。本研究结果显示,Smad4表达水平影响纤维化,hESC细胞共转染miR-34a-5p mimics和Smad4后,过表达Smad4可逆转miR-34a-5p mimics抗纤维化作用。表明Smad4与miR-34a-5p共同影响TGF-β1介导的hESC细胞纤维化进程,参与miR-34a-5p的抗增殖抗纤维化作用。
综上所述,宫腔粘连患者子宫内膜组织中miR-34a-5p表达量降低;
miR-34a-5p可抑制TGF-β1诱导的hESC细胞的增殖和纤维化;
miR-34a-5p及其靶基因Smad4共同调控hESC细胞的增殖和纤维化,有望成为宫颈粘连的新治疗靶点。
——一道江苏高考题的奥秘解读和拓展中学生物学(2022年7期)2022-09-07线粒体自噬在纤维化疾病中作用的研究进展中华实用诊断与治疗杂志(2022年1期)2022-08-31炎性及心肌纤维化相关标志物在心力衰竭中的研究进展中国现代医生(2022年21期)2022-08-22恩替卡韦联合安络化纤丸治疗慢性乙型肝炎肝纤维化的研究中国药学药品知识仓库(2022年9期)2022-05-23肝纤维化防治面临的挑战家庭医学·下半月(2022年3期)2022-04-07宫腔镜下宫腔粘连分离术联合宫腔内放置节育环对宫腔粘连的效果医学食疗与健康(2021年8期)2021-09-21宫腔粘连有什么危害吗幸福家庭(2020年14期)2020-11-13开发新方法追踪植物病害的全球传播(2020.6.7 iPlants)三农资讯半月报(2020年11期)2020-06-21小鼠转录因子STATl真核表达质粒的构建及生物学功能分析江苏农业学报(2019年1期)2019-09-10推荐访问:靶向 纤维化 子宫内膜