嗜水气单胞菌外膜蛋白缺失株逆境响应功能评价
来源:优秀文章 发布时间:2022-12-06 点击:
李泽琦,汪玉倩,李小艳,林向民,袁军
(福建农林大学生命科学学院,福建省农业生态过程与安全监控重点实验室,福州 350002)
外膜蛋白(outer membrane protein, OMP)是革兰氏阴性菌特有的一种膜结构成分,主要镶嵌在外膜及周质空间上,在营养物质运输、宿主侵染及抗逆性等方面发挥着重要作用[1-2]。例如:在不同酸碱度、温度、压力、渗透压等外界环境胁迫条件下,OmpA和OmpX等外膜蛋白能进行特异表达以阻止一些特定物质进入,从而维持细胞内稳态[3];
当大肠埃希菌暴露于酸性或高离子浓度环境下,OmpX 的表达量会在几分钟内显著增加,以调节细菌外膜的渗透性和适应性[4];
而细菌双调节系统组分OmpR的磷酸化可直接调节大肠埃希菌中主要孔蛋白OmpF 和OmpC 的转录与表达,后者以三聚体的形式形成亲水通道,使得细胞内外渗透压达到动态平衡[5]。
嗜水气单胞菌(Aeromonas hydrophila)是一种革兰氏阴性短杆菌,具有很强的环境适应性,在淡水和土壤等环境中广泛存在,并且是一种可以直接感染或与其他病原细菌共同感染的病原菌,在人和其他哺乳动物中可引起败血症或腹泻,还会对鱼类和贝类等淡水养殖动物造成影响[6]。据统计,在嗜水气单胞菌ATCC 7966 中至少存在58 个外膜蛋白(https://www.uniprot.org)[7],而当前研究多集中在OmpA、OmpF 和OmpC 等少数高丰度外膜蛋白上,缺乏对其他外膜蛋白功能的系统研究。本课题组在前期研究中已经对嗜水气单胞菌(A. hydrophila)ATCC 7966 外膜蛋白的部分生理功能及耐药特性等进行了较为系统的分析,发现某些外膜蛋白的缺失会影响该病原菌的耐药性及毒力,但这些外膜蛋白在环境胁迫下所发挥的作用尚且未知[7]。本研究在此基础上对33 株外膜蛋白缺失菌株在不同环境胁迫条件下的抗逆性进行了系统评估,以期为嗜水气单胞菌外膜蛋白的生物学功能研究奠定基础。
1.1 质粒及菌株
本实验所使用的菌株为嗜水气单胞菌ATCC 7966、大肠埃希菌MC1061 及S17-λpir。本研究所涉及的33 株外膜蛋白基因敲除菌株均保存于福建省农业生态过程与安全监控重点实验室且经过测序验证。所有菌株均在LB(Luria-Bertani)液体培养基中过夜培养,并转接培养至D(600 nm)=1.0 后备用。
1.2 基因敲除技术
本实验以自杀性质粒pRE112为载体,并以2次同源重组的方法构建遗传缺失突变体[7]。具体方法如下:分别设计约500 bp的左臂(P12)和右臂(P34),利用聚合酶链反应(polymerase chain reaction,PCR)检验设计的目的片段,并与酶切好的pRE112质粒进行连接,之后转入大肠埃希菌MC1061 以提高转化效率,再转入大肠埃希菌S17-λpir并挑取阳性单克隆,通过PCR 验证正确后将携带重组质粒的S17-λpir与受体菌(嗜水气单胞菌)培养至D(600 nm)=1.0,然后将供体菌与受体菌按4∶1的体积比例(供体菌800 μL,受体菌200 μL)加入无菌的1.5 mL 离心管并混匀,以5 000 r/min 离心5 min,在无菌环境中弃去上清液,再加入50 μL 新鲜LB 液体培养基,吸打混匀沉淀后滴于含LB固体培养基的滤纸片平板上,待自然晾干后放入30 ℃培养箱并静置培养14~16 h以进行细菌接合。将平板取出,加入500 μL新鲜LB液体培养基进行清洗,离心,弃上清液;
再加入500 μL LB 液体培养基,取100 μL 菌液涂于含有100 μg/mL 氨苄西林和30 μg/mL 氯霉素抗性的LB平板上,置于30 ℃培养箱中培养过夜。次日进行PCR验证,将验证正确的单克隆涂布于含20%蔗糖的LB固体培养基平板上,对需敲除的基因设计P5/P6引物,过夜培养后挑取单克隆进行验证,如果P5/P6无条带而对照有相应目的基因条带则结果正确。将验证正确的细菌划线纯化并保存。
1.3 嗜水气单胞菌外膜蛋白抗逆性测定
1.3.1 渗透压胁迫
本实验设置4个盐质量分数梯度,分别为0.5%、1%、3%、4%NaCl。具体方法如下:将过夜菌株转接培养至D(600 nm)=1.0 左右,取2 μL 菌液接种在配制好的含有不同质量分数NaCl的LB固体培养基平板上,对照组为普通LB固体培养基(含1%NaCl),然后置于30 ℃培养箱中静置培养16 h,观察并记录结果。上述实验至少重复2次。
1.3.2 金属离子胁迫
分别配制含有铁(Fe3+)、锌(Zn2+)、铬(Cr6+)和钴(Co2+)4 种金属离子的M9 固体营养限制性培养基(0.4%葡萄糖,5×M9,1.5%琼脂粉,2% 1 mol/L MgSO4,1% 0.1 mol/L CaCl2,1%微量元素,1%生长因子),其终质量浓度分别为400、800、0.025、0.000 16µg/mL。将D(600 nm)=1.0的菌液以1∶100体积比添加到1 mL LB液体培养基中,取2 μL滴加在含有不同金属离子的M9培养基上,于30 ℃培养箱中静置培养16 h后拍照,保存。上述实验至少重复2次。
1.3.3 pH 胁迫
配制pH梯度分别为6.0、7.5和8.5的LB液体培养基。酸性培养基配制方法为在50 mL LB 液体培养基中加入1.07 g 2-(N-吗啉代)乙磺酸(MES),混匀后用HCl 将pH 调至6.0。碱性培养基配制方法为在50 mL LB 液体培养基中分别加入1 g 3-(N-吗啡啉)丙磺酸(MOPS)和1.1 g 3-[(1,1-二甲基-2-羟乙基)氨基]-2-羟基-1-丙磺酸(AMPSO),并用KCl 将pH 分别调至7.5 和8.5。上述培养基均经高压灭菌后保存,备用。将菌液按1∶100 体积比添加到各pH 梯度培养基中,然后将混合菌液按每孔300 μL 加入96 孔板进行培养,最后利用全自动生长曲线分析仪(芬兰Bioscreen 公司)进行测定。每个pH 重复3 次,每小时测定一次并记录数据,连续培养16 h。
1.3.4 H2O2胁迫
将菌液以1∶100体积比添加到1 mL LB液体培养基中,加入终浓度为2.5 mmol/L 的H2O2,振荡混匀并在室温条件下静置10 min,吸取2 μL 滴在LB固体培养基平板上,在30 ℃培养箱中静置培养16 h,观察结果并拍照,保存。
1.4 数据分析
通过STRING 在线网站(https://string-db.org/)构建蛋白质-蛋白质相互作用预测网络,并结合实验中的表型结果,利用Cytoscape 3.6.1 软件实现可视化[7]。
2.1 敲除菌株的验证
本研究利用同源重组敲除技术对33株菌的外膜蛋白基因进行敲除,并利用P5/P6引物对目的条带进行扩增,部分结果如图1所示。野生型菌株在相应位置有一条明亮的条带;
而ΔAHA_2991、ΔAHA_0569、ΔAHA_3509和ΔAHA_0521等菌株在对应位置无条带,说明它们的外膜蛋白基因均被成功敲除(其余基因的敲除结果已发表[7])。

图1 野生型菌株与部分外膜蛋白基因敲除菌株的PCR 扩增结果Fig.1 PCR amplification results of wild type (WT) strain and partial OMP gene knockout strains
2.2 渗透压胁迫检测结果
为了解嗜水气单胞菌外膜蛋白在不同渗透压胁迫下的功能,对构建的33个外膜蛋白基因敲除菌株进行了盐胁迫研究。以1%NaCl 作为对照,分别测定了野生型菌株与敲除菌株在0.5%、3%、4%NaCl条件下的生长情况。如图2所示,在4%NaCl条件下,ΔlptD(19)、ΔAHA_0904(23)、ΔAHA_0461(25)和ΔAHA_4275(28)菌株与野生型菌株相比具有更高的盐胁迫耐受性,而在其他NaCl质量分数条件下无明显区别。

图2 野生型菌株与外膜蛋白基因敲除菌株在不同质量分数NaCl条件下的测定结果Fig.2 Determination results of WT strain and OMP gene knockout strains under different concentrations of NaCl
2.3 pH 胁迫检测结果
为研究嗜水气单胞菌外膜蛋白在应对pH 胁迫时的表型变化,分别检测了野生型和33株外膜蛋白基因敲除菌株在pH 为6.0、7.5 和8.5 条件下的生长趋势。如图3 所示,在3 种pH 条件下,ΔAHA_0461菌株的生长均好于野生型菌株,而ΔAHA_4275菌株则均略弱于野生型菌株;
其余菌株生长状态与野生型相比无明显差异。
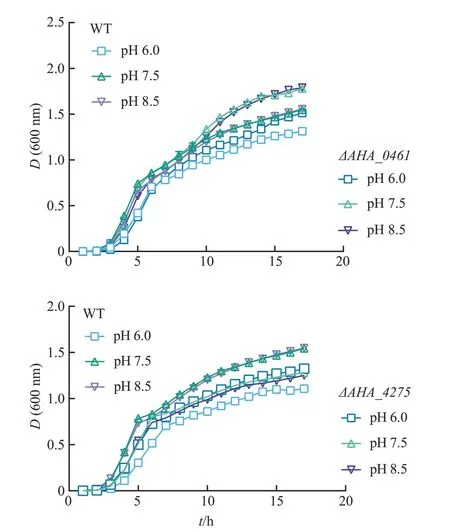
图3 野生型菌株与外膜蛋白基因敲除菌株在不同pH条件下的生长情况Fig.3 Growth status of WT strain and OMP gene knockout strains under different pH conditions
2.4 H2O2胁迫检测结果
如图4 所示:在2.5 mmol/L H2O2胁迫条件下,ΔAHA_1279(7)、ΔAHA_1281(8)、ΔAHA_2145(10)、ΔpilQ(16)、ΔbamA(17)、ΔAHA_0461(25)和ΔAHA_0569(32)菌株的生长状态与野生型菌株相比都有不同程度的削弱,其中以ΔpilQ(16)和ΔbamA(17)菌株最为明显;
其余菌株的生长状态与野生型相似。
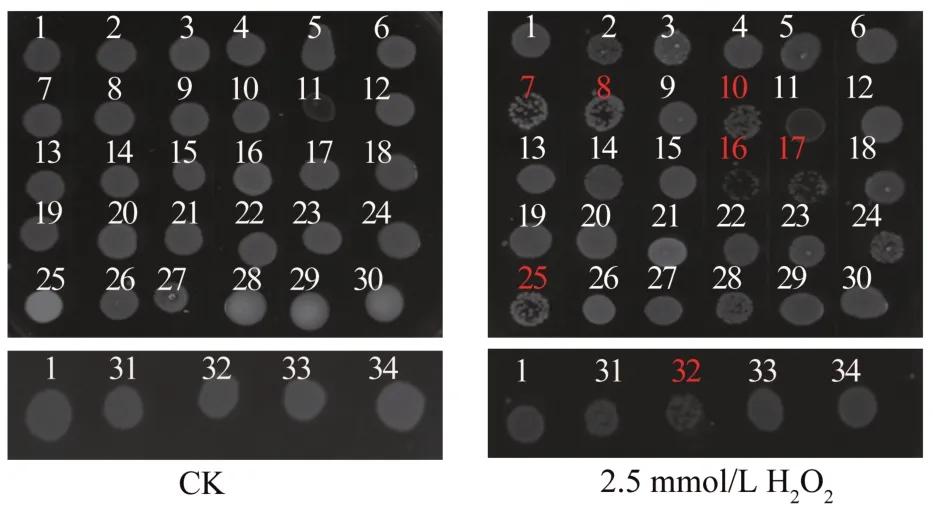
图4 野生型菌株与外膜蛋白基因敲除菌株在不同H2O2浓度下的生长情况Fig.4 Growth status of WT strain and OMP gene knockout strains under different concentrations of H2O2
2.5 金属离子胁迫检测结果
为研究嗜水气单胞菌外膜蛋白在应对不同金属离子胁迫下的作用,本实验比较了在Fe3+(FeCl3)、Zn2+(ZnCl2)、Cr6+(K2Cr2O7)和Co2+(CoCl2)4 种金属离子胁迫条件下野生型与敲除菌株的生长情况。如图5 所示:在ZnCl2处理条件下,ΔAHA_2766(5)、ΔAHA_1279(7)、ΔAHA_2282(11)和ΔompW(14)菌株的生长较野生型菌株受到明显抑制;
在K2Cr2O7和CoCl2处理条件下,ΔAHA_2145(10)和ΔAHA_2282(11)菌株的生长较野生型菌株受到抑制;
而在FeCl3处理条件下,33个外膜蛋白基因缺失菌株与野生型菌株相比没有明显差异。

图5 野生型菌株与外膜蛋白基因敲除菌株在不同金属离子胁迫下的生长情况Fig.5 Growth status of WT strain and OMP gene knockout strains under different metal ion stresses
2.6 蛋白质相互作用预测结果分析
综合以上研究结果与STRING 软件预测,对外膜蛋白缺失菌株受pH、H2O2、金属离子及渗透压胁迫表型进行汇总,并对33个外膜蛋白互作网络进行预测。结果(图6)表明,除AHA_0389、AHA_2202和AHA_2699 外,其余外膜蛋白都参与了蛋白质互作网络,说明嗜水气单胞菌的外膜蛋白具有复杂的蛋白质互作调控网络。

图6 33个外膜蛋白互作网络预测结果及其响应环境胁迫表型汇总Fig.6 Prediction results of interaction networks of 33 OMPs and summary of the phenotypes responding to environmental stresses
外膜蛋白在革兰氏阴性细菌的生命活动中起着至关重要的作用。目前,研究者已通过遗传、生化和结构分析等方法对许多典型的外膜蛋白进行了详细的研究[8],但是关于外膜蛋白在鱼类病原菌嗜水气单胞菌中的生物学特性的报道很少。本研究对嗜水气单胞菌中33 个外膜蛋白基因敲除菌株在不同环境胁迫下的表型进行了较为系统的研究。结果显示,一些外膜蛋白基因敲除菌株在不同环境条件下表型发生了变化,提示这些外膜蛋白在相应环境胁迫中具有重要的生物学功能。
温度和pH 等物理化学条件可以对膜蛋白的功能及营养物质的扩散等产生影响,从而破坏膜的完整性。在pH 为6.0、7.5 和8.5 胁迫条件下,ΔAHA_0461菌株的生长强于野生型,而ΔAHA_4275菌株弱于野生型。AHA_0461和AHA_4275都属于TonB依赖性受体家族蛋白(TonB-dependent receptors,TBDRs),该家族蛋白可以结合并转运少量但重要的营养物质,并会影响抗性因子及毒力因子的产生及运输[9],这可能是ΔAHA_0461和ΔAHA_4275菌株表型的生长区别于野生型菌株的原因之一。
ΔlptD、ΔAHA_0904、ΔAHA_0461和ΔAHA_4275菌株在4% NaCl 胁迫条件下较野生型菌株生长更好。AHA_0904编码了未知功能的蛋白质,其具体功能尚需进一步研究。LptD是一种β-桶状外膜蛋白,在大肠埃希菌中LptD和LptE的突变会导致其外膜的通透性增加[10];
本研究结果与其在大肠埃希菌中的报道并不完全一致,说明该基因在适应环境胁迫等方面还起到了其他的作用。AHA_0461和AHA_4275所属的TonB家族蛋白可以对抗性因子及毒力分子的转运产生影响[9],它们对pH 胁迫、盐胁迫和H2O2胁迫都能够产生响应,说明TonB系统可能在维持嗜水气单胞菌细胞稳态中起重要的作用。
氧化应激作为一种对环境胁迫的响应会对细菌细胞造成影响,使其生长速率降低,在极端环境下还会造成细胞死亡。而外膜蛋白为革兰氏阴性细菌抵御外界环境变化的第一道防线,可能在响应氧化应激环境等方面发挥作用。在H2O2处理条件下,ΔAHA_1279、ΔAHA_1281、ΔAHA_2145、ΔpilQ、ΔbamA、ΔAHA_0461和ΔAHA_0569菌株的生长与野生型菌株相比都有不同程度的减弱。研究表明,长链脂肪酸在细菌感染过程中起到适应外界环境的作用,并能够帮助细胞对应激条件产生一定的耐受性[11]。AHA_2145编码长链脂肪酸转运蛋白,该蛋白的缺失可能导致嗜水气单胞菌在H2O2胁迫和金属离子胁迫条件下生长缓慢。AHA_1279和AHA_1281同属于OmpA 家族蛋白基因,该家族蛋白具有维持细胞结构稳定的功能[12],H2O2则可能通过影响细胞结构的稳定性而影响细菌的生长状态。pilQ和AHA_0569分别编码分泌素家族蛋白。蛋白质分泌系统为细菌生长所必需,敲除编码分泌素家族蛋白基因不利于运输通道对胁迫因子进出的控制,从而使细菌生长受到影响。BamA(AHA_1181)可参与细菌膜蛋白的插入及分泌[13],H2O2能够攻击细菌的细胞膜,从而对膜上的β-桶状结构造成破坏[14]。因此,BamA的缺失不利于嗜水气单胞菌抵御外界环境胁迫,从而造成该菌生长状态的异常。
地球环境的多样性导致局部区域的金属元素含量不平衡,也迫使周围微生物的生长代谢发生适应性改变。在大多数细菌中,铜、镉或镁等金属可通过细胞膜上的特异性通道进行运输,并存在代谢胞内多余金属离子的机制[15]。在ZnCl2、K2Cr2O7和CoCl2胁迫条件下,ΔAHA_2766、ΔAHA_1279、ΔAHA_2282、ΔompW(ΔAHA_3953)和ΔAHA_2145菌株的生长均弱于野生型菌株。AHA_2282和AHA_0904编码未知功能的蛋白质,它们分别响应金属离子和渗透压的胁迫,因而可能参与了嗜水气单胞菌对环境胁迫的适应过程。AHA_1279(ompAⅡ)作为ompA的等位基因,可能也具有维持细胞外膜稳态和离子通道活性的作用[16],这或许是ΔAHA_1279菌株在Zn2+处理条件下生长较弱的原因。AHA_2766与创伤弧菌MtrB/PioB家族中血红素相关外膜蛋白具有氨基酸序列同源性。MtrB/PioB家族蛋白具有Fe(Ⅲ)和Mn(Ⅳ)还原以及细胞外电子转移等功能[17]。本研究结果提示,MtrB 的同源蛋白AHA_2766可能也具有电子转移的功能。AHA_3953编码OmpW家族蛋白。研究表明,革兰氏阴性菌中的小孔蛋白OmpW参与了铁转运、膜结构稳定以及应激适应等生理过程[18]。但在本实验中,OmpW 突变株对高浓度铁胁迫环境并不敏感,因而推测OmpW家族蛋白在嗜水气单胞菌中可能具有独特的功能。此外,ΔAHA_3953菌株在Zn2+胁迫条件下的生长较弱,表明OmpW 作为小孔蛋白可能也参与了Zn2+的运输。
综上所述,外膜蛋白作为保护细菌内稳态的屏障,在营养物质运输、离子运输、毒力因子的分泌、环境抗逆性以及抗生素耐药性等方面都具有重要的作用。本研究通过对33 个嗜水气单胞菌外膜蛋白缺失菌株生理表型的系统分析,发现多个外膜蛋白在响应不同的环境胁迫条件中具有重要的作用。本研究结果有助于深入了解外膜蛋白的生理功能,并为今后全面地了解细菌外膜蛋白的生物学功能奠定了科学基础。
猜你喜欢 水气单胞菌菌株 食品微生物检测实验室标准菌株的管理和质量控制食品安全导刊(2022年11期)2022-11-17含ACC 脱氨酶的PGPR 对东方百合‘Souvenir’生长的影响现代园艺(2022年9期)2022-06-07辽中区患病草鱼体内嗜水气单胞菌分离、鉴定与致病力测定当代水产(2022年3期)2022-04-26植物根际促生菌Bacillus mycoides Gnyt1菌株生物学特性比较研究草地学报(2022年3期)2022-03-28好好刷牙能防老痴文萃报·周五版(2019年45期)2019-09-10好好刷牙能防老痴华声文萃(2019年12期)2019-09-10免疫球蛋白IgY对牙龈卟啉单胞菌诱导的牙周炎大鼠模型的影响华东师范大学学报(自然科学版)(2019年3期)2019-06-24酝酿鹿鸣(2018年1期)2018-01-30英国红松鼠携带麻风病菌株大自然探索(2017年8期)2017-08-28水稻水气栽培试验总结农家科技下旬刊(2016年7期)2016-10-21推荐访问:水气 逆境 缺失