儿童肝移植术后重症监护室早期感染特征及其相关因素分析
来源:优秀文章 发布时间:2022-12-03 点击:
张铮铮 陶金好 闫钢风 程 晔 蔡小狄 陈 扬谢新宝 陈 功 陆国平 陈伟明△ 沈丛欢
(1国家儿童医学中心/复旦大学附属儿科医院重症医学科,2肝病科,3普外科 上海 201102;
4复旦大学附属华山医院肝外科 上海 200040)
肝移植(liver transplantation,LT)作为挽救肝功能衰竭儿童最后的治疗措施,近年在国内蓬勃开展[1-4]。肝移植术后监护阶段,由于患儿接受腹部大手术、术后免疫抑制剂应用、各种侵入性治疗、术前低营养状态及其他因素,增加了患儿侵袭性感染的风险。有研究显示,接受肝移植手术儿童约一半在早期阶段患有细菌感染[1],感染性并发症是肝移植术后最主要的死亡因素之一[5],其发生率及病死率均超过术后排斥反应。目前国内外对于儿童肝移植术后感染研究较少[6-8],也未形成儿童肝移植术后预防感染措施的诊疗规范。本研究回顾性分析复旦大学附属儿科医院儿科重症监护室(Pediatric Intensive Care Unit,PICU)连续收治的肝移植术后监护患儿的感染发生情况,以期了解儿童肝移植术后感染状况,分析其发生的相关因素,为规范儿童肝移植术后感染预防措施提供临床依据。
研究对象本研究经复旦大学附属儿科医院伦理委员会审核批准[伦理编号:复儿伦审2019(291)],纳入重症监护室在2014年1月—2019年12月间连续收入重症监护室的儿童肝移植病例。纳入标准:(1)接受过肝移植手术;
(2)肝移植手术≤7天。排除标准:资料不全无法分析者。所有移植供体和移植受体均经复旦大学附属华山医院机构伦理委员会审查通过。
病例资料及研究变量定义
预防性抗感染方案[9]采用哌拉西林/他唑巴坦静脉输注,每次100 mg/kg,每8 h 1次,进行术前及术后预防性抗感染治疗,若遗体捐献肝移植患儿再加用替考拉宁输注(每日10 mg/kg);
所有患儿均接受预防性抗真菌治疗(氟康唑4 mg/kg,qd输注)及预防剂量抗耶氏肺孢子虫治疗(复方新诺明每次0~15 mg/kg,bid口服)。抗巨细胞病毒及乙肝病毒治疗根据供受体情况决定,若患儿肝移植术前存在感染则根据术前病原学检查选取抗感染药物。其他预防感染措施包括:单间隔离、呼吸机相关肺炎预防策略、导管相关血流感染预防措施等。
免疫抑制治疗 免疫抑制剂通常采用他克莫司+激素二联方案,移植术中应用甲基强的松龙10 mg/kg,使用1剂,术后激素起始量每日5 mg/kg,逐步递减,一般在术后1~3个月减停。他克莫司术后开始应用,起始剂量每日0.1~0.15 mg/kg,服用3剂后测量药物谷浓度,PICU治疗期间目标血药浓度8~12 ng/mL,根据浓度调整剂量。若患儿术后出现急性肾损伤,加用吗替麦考酚酯(每日20 mg/kg),同时减少甚至减停他克莫司、适当增加激素用量。当患儿出现重症感染(重症肺炎、脓毒症、真菌感染)时减少或者暂停应用免疫抑制剂。
术后感染的定义 本文所指术后PICU感染的主要类型包括下呼吸道感染、腹腔感染、血流感染、泌尿道感染等。术后感染定义分为临床诊断及病原学诊断。术后感染诊断标准包括临床标准:发热和(或)感染症状体征(下呼吸道感染,腹腔内感染,腹腔感染,切口感染,泌尿道感染等);
实验室指标如血象白细胞总数和(或)中性粒细胞比例增高等;
影像学指标如X线显示炎性浸润等;
微生物标准为病原学培养阳性。具体诊断标准参考我国卫生部2001年的《医院感染诊断标准》[10]。本研究收集分析的患儿在PICU期间发生的感染,由专职人员通过回顾性查阅病史资料,结合临床表现、实验影像学资料及病原学检测结果进行综合判断。
统计学分析采用Stata 14.0软件进行统计分析。根据数据类型,连续变量采用x±s表示,符合正态分布的两组间比较采用t检验;
非正态分布以中位数M和四分位数(IQR)表示,两组间比较采用秩和检验;
分类变量用构成比表示,组间比较采用χ2检验或校正的χ2检验或Fisher确切概率法表示。单因素或多因素分析用Logistic回归分析。P<0.05为差异有统计学意义。
研究对象基本特征根据纳排标准,共纳入70例患儿,其中男性46例、女性24例;
接受肝移植儿童月龄中位数为8.8(6.6~12.5)个月,体重中位数为7.5(6.6~8.6)kg,其中53例儿童亲体肝移植,14例遗体捐献肝移植。病因包括:先天性胆道闭锁40例,先天性胆汁淤积症15例,Alagille综合征5例,肝硬化3例,其他7例(图1);
7例患儿术前住院治疗有接受抗生素治疗病史。术后PICU留滞时间中位数为6.5(5~9)天,术后接受机 械 通 气治疗45例(64.3%),术后机械通气天数中位数为2(0~4)天;
术后深静脉(central venous catheter,CVC)留置65例(92.8%),深静脉留置时间中位数为6(4~9)天;
导尿管留置66例(94.3%),留置时间中位数为4(3~7)天。出PICU存活66例(94.3%),死亡4例,具体临床特征见表1;
死亡病例死因包括:重症感染2例(1例合并胆瘘,1例腹腔间隔综合征),原发性移植物无功能、门静脉血栓各1例。

图1 儿童肝移植病例病因分布图Fig 1 Etiology distribution of child liver transplantation
术后感染情况肝移植术后发生感染病例为31例(44.3%),其中27例(87.1%)患儿微生物培养阳性,共分离病原菌131株,来源分别为下呼吸道(深部痰液及支气管肺泡灌洗液)、腹腔引流液、血液及中心导管、尿路。多部位感染常见,同一病例2个部位及以上的感染率为45.0%。分离的病原菌中革兰阴性杆菌(G-杆菌)为主,其次为真菌、革兰阳性菌。前三位细菌分别为鲍曼不动杆菌、嗜麦芽窄食单胞菌及铜绿假单胞菌(图2),其中鲍曼不动杆菌和铜绿假单胞菌多重耐药菌株常见(图3、4)。图3所示,对鲍曼不动杆菌菌株敏感度较高的药物分别是替加环素(93%),黏菌素(81%敏感,6%中介),左氧氟沙星(25%敏感,37%中介),米诺环素(45%敏感,10%中介);
图4所示,在本中心所做的药敏试验中,对铜绿假单胞菌敏感的药物仅为庆大霉素(67%敏感,16%中介)。真菌感染以白色念珠菌为主,对氟康唑均敏感。按照标本来源,下呼吸道最主要致病菌为鲍曼不动杆菌,其次为白色念珠菌;
腹腔感染最主要致病菌为假单胞菌;
血流及尿路感染主要致病菌分别为鲍曼不动杆菌及白色念珠菌,具体病原菌见表1。

图2 儿童肝移植病例临床培养病原体分布Fig 2 Distribution of pathogens in children after liver transplantation

图3 鲍曼不动杆菌的耐药分析Fig 3 Analysis of the resistance of Acinetobacter baumannii

图4 铜绿假单胞菌的耐药分析Fig 4 Drug resistance analysis of Pseudomonas aeruginosa
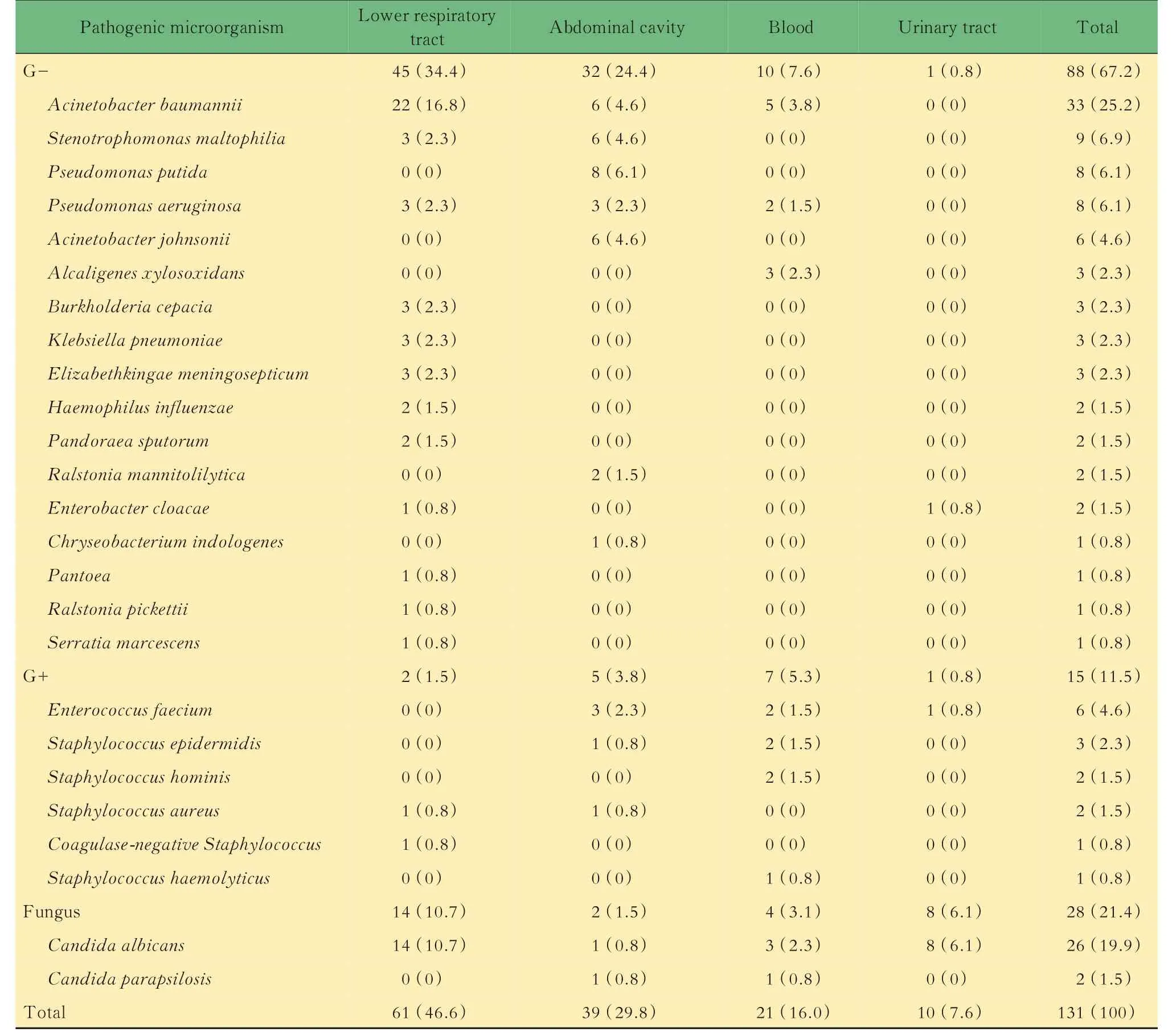
表1 肝移植术后感染病例感染部位构成Tab 1 Theinfection site distribution of children after liver transplantation [n(%)]
感染相关因素分析按照是否发生感染将患儿分为感染组和非感染组,术后发生感染病例31例,未发生感染31例,其余8例为疑似感染,不纳入分组。感染组与非感染组临床特征比较:中心静脉导管留置天数、ICU住院天数、手术小时数和FK 506浓度在感染组和非感染组间差异有统计学意义(P<0.05),年龄、体重、性别、机械通气小时数、导尿管留置天数、术中血制品术中量及术前PELD评分与术后感染差异无统计学意义(表2)。

表2 儿童肝移植术后感染组与非感染组临床特征比较Tab 2 Comparison of clinical characteristics between infected group and non-infected group [n or M(IQR)]
术后感染相关的多因素Logistic分析将上述单因素分析中有统计学意义的变量结合临床实践,选取年龄、机械通气、深静脉留置、手术时间及他克莫司浓度进行多因素Logistic分析(表3),提示手术儿童年龄<1岁与肝移植术后感染存在一定的相关性;
有创通气>5天、CVC留置>7天、手术时间>8 h和血清FK506浓度>16 ng/mL与肝移植术后感染之间未发现相关性。

表3 儿童肝移植术后感染相关因素的Logistic分析Tab 3 Multivariate analysisof infection-related factors in children after liver transplantation
目前国内关于儿童肝移植术后感染研究尚不多。本研究对70例儿童肝移植术后入住PICU的临床资料分析显示,术后合并细菌及真菌感染比例为44.3%(31/70),这与国内报道儿童肝移植早期感染发生率为22.9%~37.2%相仿[11-12];
低于国外儿童肝移植术后感染发生率(德国51.9%,法国70.8%)[13-14]。本研究显示感染病原体以G-杆菌为主(占67%),革兰阳性球菌(G+球菌)为11%,真菌感染占21%;
Pouladfar等[15]对中东地区94名儿童肝移植患者统计显示,其术后早期感染以肠球菌(36.1%)及葡萄球菌(11.1%)等G+球菌感染为主(占47.2%);
G-杆菌主要是肠杆菌(21.3%)、不动杆菌(16.7%)及假单胞菌(9.2%)。欧洲地区儿童肝移植术后感染病原学统计也是G+球菌占主导地位[13,16]。国内儿童肝移植早期感染病原学分布与国外报道并不一致,这可能与不同国家地区重症监护室引起院内感染病原体流行病学差异相关。
本研究同时发现G-杆菌感染以不动杆菌属(占25.2%,39/131株)和假单胞菌属(19.1%,25/131株)为主,在检出的致病G-杆菌中符合多重耐药(multidrug resistant,MDR)病 原 体 定 义[17]的 占58.3%(35/68株),这与国外报道数据近似,Hand等[18]研究发现MDR革兰阴性杆菌在肝移植患者术后早期感染率超过50%;
Singh等[19]报道肝移植后绿脓假单胞菌MDR菌株检出率为45%,而肠杆科细菌MDR菌株检出率超过65%。上述研究均提示对于儿童肝移植术后G-杆菌感染病原体耐药情况严重,由于MDR菌株感染是肝移植术后死亡的相关因素,肝移植术后临床出现感染症状时,采用经验性抗感染治疗应选择覆盖MDR-G-杆菌病原体的抗生素。而本研究G+球菌检出率不高,也未检出对万古霉素耐药及中介的肠球菌及葡萄球菌菌株;
Pouladfar等[15]对儿童肝移植后早期感染研究显示其耐万古霉素肠球菌检出占致病肠球菌80%以上,提示国内儿童肝移植G+球菌感染耐药情况较国外文献报道要低。本研究真菌检出率21%,感染病原体主要为念珠菌属,其中白色念珠菌占74.3%(26/35株)且对氟康唑均敏感。而Raghuram等[20]一项肝移植术后侵袭性真菌感染回顾性研究显示,肝移植术后真菌感染发生率为12%,其中55%由非白色念珠菌感染引起,且超过一半念珠菌对氟康唑耐药。国内外感染病原体及菌株耐药性的流行病学差异,在儿童肝移植抗感染预防及经验性诊疗过程中值得我们重视。就本中心数据显示,对于儿童肝移植术后若出现感染症状需要高度警惕G-杆菌感染,且经验性抗感染治疗需要覆盖MDR菌株;
若怀疑G+球菌或念珠菌感染,对常规一线药物治疗效果往往良好。
肝移植术后合并细菌及真菌感染发病率超过50%,常归因于肝移植较其他实质器官移植操作更加复杂,术后易合并腹腔感染、胆瘘及血管相关并发症[21]。其他文献报道[22-23]导致肝移植术后感染发生因素包括患者年龄、术前终末期肝病模型评分>30分、术后免疫抑制状态、术后接受连续性血液净化(continuous blood purification,CBP)治疗、暴露环境特定病原体(医院病原体)、ICU留滞时间延长及移植后再次手术等。本研究资料显示儿童肝移植术后发生感染部位依次为肺部感染、腹腔感染及血流感染,发生术后感染的危险因素包括(1)患者因素:年龄<1岁,术后免疫抑制剂浓度过高;
(2)手术操作因素:肝移植手术超过8小时;
(3)术后监护因素:机械通气、深静脉留置时间过长及ICU留滞时间过长。
虽然多因素分析中,手术时间、深静脉留置等未能证实对肝移植术后感染产生显著影响,但深静脉留置>7天对应的OR值高达2.92,FK 506浓度>16 ng/mL对应的OR值为1.86,仍有一定临床意义。由于肝移植患儿并非常见,患儿数量及临床资料珍贵且有限,如今后能扩大样本量分析,这些指标值得深入研究。随着儿童肝移植手术技术的成熟,手术相关因素对感染的发生影响相对较小;
本研究未出现肝移植术后再次手术的病例,出现肝移植外科并发症仅2例(1例胆瘘、1例门静脉血栓),均合并血流感染而出现致死不良结局。本研究术后感染组较非感染组主要差异为术后侵入性诊疗措施留置时间长短及重症监护室留滞时间,这提示对于儿童肝移植术后患者需要每日评估有创治疗措施如深静脉导管、气管插管等必要性,尽可能缩短有创导管的留滞时间;
本研究感染组另一个高危因素为免疫抑制剂他克莫司浓度高于非感染组[15.9(11.1,22.8)vs.9.5(5.6,16.9),P=0.014]。Schwake等[24]报道儿童肝移植术后他克莫司浓度>20 ng/mL为手术部位感染及发生脓毒症的独立危险因素,这与本研究结果类似。目前糖皮质激素及钙调神经磷酸酶抑制剂的组合成为肝移植后主流免疫抑制方案[25],他克莫司作为临床主要应用的CNI药物与很多药物存在相互作用,容易引起血药浓度大幅波动[26]。因此临床应用他克莫司需要熟悉药物相互作用同时定期监测血药浓度避免免疫抑制过度,增加院内感染的发生概率。
本研究不足之处在于:(1)属于单中心回顾性研究,纳入儿童肝移植术后感染的病例数偏少,获得的术后感染流行病学资料相对比较局限;
(2)偏倚因素较多。
本研究结果显示,近年儿科医院收治的儿童肝移植术后患儿早期细菌及真菌感染发生率高,感染部位以呼吸道及腹腔感染为主,感染病原体以G-杆菌及白色念珠菌为主,其中G-杆菌具有泛耐药特点。移植后早期感染因素可能与患儿的年龄(小于1岁)、手术时间长、深静脉导管留置时间长、PICU住院时间长以及他克莫司浓度过高有关。进一步研究应在相对标准化术后监护方案下开展多中心前瞻性队列研究以明确我国儿童肝移植术后感染流行病学资料及危险因素,为制订国内儿童肝移植术后抗感染诊疗方案提供理论依据。
作者贡献声明张铮铮 采集数据,实施研究,数据统计和分析,论文撰写和修订。陶金好,程晔,蔡小狄,陈扬,陈伟明 研究设计,数据整理。陈功,陆国平 监督指导,可行性分析。闫钢风,谢新宝,沈丛欢 科研设计,数据统计和分析指导。
利益冲突声明所有作者均声明不存在利益冲突。
猜你喜欢 球菌单胞菌肝移植 辽中区患病草鱼体内嗜水气单胞菌分离、鉴定与致病力测定当代水产(2022年3期)2022-04-26宏基因组测序辅助诊断原发性肺隐球菌中国典型病例大全(2022年7期)2022-04-22延续护理在肝移植患者术后出院自我管理中的临床分析中国典型病例大全(2022年9期)2022-04-19让活体肝移植研究走上世界前沿华人时刊(2020年21期)2021-01-14好好刷牙能防老痴文萃报·周五版(2019年45期)2019-09-10好好刷牙能防老痴华声文萃(2019年12期)2019-09-10临床检验科普之你不知道的肠球菌特别健康·下半月(2019年7期)2019-07-29免疫球蛋白IgY对牙龈卟啉单胞菌诱导的牙周炎大鼠模型的影响华东师范大学学报(自然科学版)(2019年3期)2019-06-24本院引起泌尿系统感染的148株肠球菌耐药性分析特别健康·下半月(2017年5期)2017-06-15天津完成全国首例供受体双“镜像人”亲体肝移植健康管理(2016年7期)2016-05-14推荐访问:术后 重症 及其相关推荐文章
- 大学生违规检讨书范文【三篇】:学生通用检讨书10000字
- 2018年农村青年入党申请书 2018农村青年入党申请书【五篇】
- 【小学二年级描写春天的作文500字】 小学二年级描写夏天的作文
- 安徽省宿州市埇桥区天气 安徽省宿州市埇桥区兴农供销集团有限责任公司招聘公告
- [河北省2018上半年教师资格考试面试成绩查询入口【已公布】]2018中级会计成绩查询
- 【2018上半年广东教师资格面试成绩查询入口【已公布】】2018中级会计成绩查询
- [上班早退检讨书]员工早退检讨书怎么写
- 江苏省中国科学院植物研究所2018专业技术岗招聘启事:中国科学院植物研究所
- 【2018年9月山东全国计算机等级考试网报时间:6月19日】2018年9月全国计算机等级考试
- [澳洲188C投资移民政策]投资移民加拿大条件