载阿霉素红细胞膜壳聚糖靶向纳米粒的制备及评
来源:优秀文章 发布时间:2022-10-21 点击:
洪伟勇 周旭晖 金陈浩 王金明 郭钫元 杨根生






关键词红细胞膜;纳米粒;叶酸受体;靶向给药系统;抗肿瘤
恶性肿瘤严重威胁人类健康,化学药物治疗仍是目前主要的治疗手段之一。阿霉素(doxorubicin,DOX)是最常用的化学治疗药物,对乳腺癌、肺癌、膀胱癌等具有较明显的抗肿瘤作用,是多种肿瘤的一线化疗药物;但其具有骨髓抑制、心脏毒性、耐药性等缺点,从而限制了其临床应用[1]。红细胞是血液中數量最多、寿命最长的细胞,也是运送氧气的主要媒介[2];其作为内源性物质,具有极强的流动可塑性、高生物相容性、可生物降解性、超长的半衰期和低免疫原性等优点[3 - 6];通过修饰还可以将其构建成靶向肿瘤的药物递送系统[7-9],现已成为抗肿瘤药物研发的一个新热点。叶酸(folic acid,FA)受体是公认的肿瘤细胞生物标志物,在大量肿瘤(特别是乳腺癌、宫颈癌、肝癌等多种实体瘤)中过表达[7,10],而在正常细胞中很少表达,是理想的靶向药物递送受体[11-12]。
基于此,本研究以DOX为模型药物,壳聚糖为载体材料,采用离子交换法制备载阿霉素壳聚糖纳米粒(DOX-CS-NPs),将FA 和氨基聚乙二醇磷脂(NH2-PEG2000-DSPE)通过共价连接后修饰红细胞膜(RBC),并构建靶向肿瘤细胞FA受体的载阿霉素红细胞膜壳聚糖靶向纳米粒(FA-RBC-DOX-CS-NPs),考察该纳米粒的理化性质和体外释药特性,并评价其抗肿瘤活性,以期为DOX的新制剂开发提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器有IL-161CT型CO2培养箱[施都凯仪器设备(上海)有限公司],Malvern ZS90 型激光纳米粒径仪(英国马尔文仪器有限公司),Nicolet 6700 型傅里叶变换红外光谱仪、Fresco 21 型高速冷冻离心机(美国Thermo Fisher Scientific 公司),ELx800 型酶标仪(美国BioTek 公司),UV-2102 型紫外可见分光光度计(美国Unocal 公司),LSM 900 型共聚焦显微镜(德国Carl Zeiss 公司),X’pert PRO 型X 射线衍射仪(荷兰PNAlytical 公司),AVANCE-Ⅲ型核磁共振波谱仪(德国Bruker公司)。
1.2 主要药品与试剂
FA、壳聚糖和三聚磷酸钠(批号分别为20180607、20181009、201812110)购于上海阿拉丁生化科技有限公司;NH2-PEG2000-DSPE(批号20181022)购于上海凡硕生物科技有限公司;DOX(批号20180809)购于武汉远成共创科技有限公司;DMEM 高糖培养基(批号19126245)购于美国Sigma 公司;MTT 试剂(批号2002316)购于北京索莱宝科技有限公司;DAPI 染色液(批号20191116)购于上海颖心实验室设备有限公司;1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDC,批号20180928)购于浙江普康化工有限公司;N-羟基琥珀酰亚胺(NHS,批号20180821)购于上海麦克林生化科技有限公司;其余试剂为实验室常用规格,水为纯净水。
1.3 细胞
人乳腺癌MCF-7 细胞购于上海生命科学研究所细胞资源库。
1.4 动物
本研究所用动物为健康雄性SD大鼠,共9 只,体质量为180~200 g,鼠龄为8 周,由浙江省医学科学院提供,动物生产许可证号为SCXK(浙)2019-0002。实验期间正常光照,动物饲养室环境温度为20~22 ℃,相对湿度为55%~60%,大鼠自由饮水采食。
2 方法
2.1 叶酸氨基聚乙二醇磷脂的合成
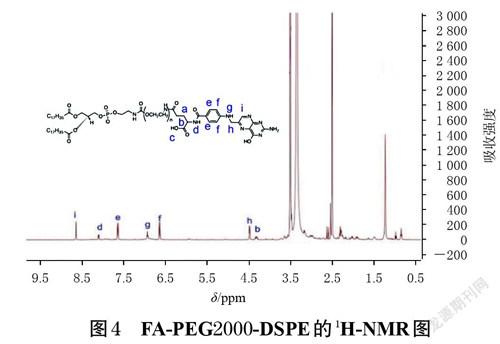
取7.94 mg FA溶于10 mL无水二甲基亚砜(DMSO)中,加入6.9 mg EDC和4.14 mg NHS,室温避光活化4 h,加入30 mg NH2-PEG2000-DSPE,避光,室温反应24 h(具体合成路线见图1),然后置于去离子水中透析(透析袋截留相对分子质量为3 000 Da)36 h,收集产物并冻干,即得叶酸氨基聚乙二醇磷脂(FA-PEG2000-DSPE)。采用核磁共振氢谱(1H-NMR)表征FA、NH2-PEG2000-DSPE和FA-PEG2000-DSPE的结构。
2.2 RBC的制备
取SD雄性大鼠血液,加入10 倍体积的1×磷酸盐缓冲液(PBS),于4 ℃下以4 500 r/min 离心10 min,取沉淀,以1×PBS洗涤3 次,即得红细胞。将红细胞置于4 倍体积的0.25×PBS 中,于4 ℃下低渗处理40 min,以释放红细胞内容物;再以8 000 r/min 离心15 min,取沉淀,以0.25×PBS洗涤2 次,即得粉色的RBC,备用。
2.3 FA修饰RBC的表征
取“2.1”项下FA-PEG2000-DSPE 适量,以1×PBS 配制成质量浓度为50 μg/mL 的溶液(2 mL),加至等体积RBC溶液中,置于37 ℃、100 r/min 摇床上避光孵育1 h;再于4 ℃条件下用1×PBS洗涤离心(8 000 r/min)2 次,即得FA修饰的RBC(FA-RBC)。采用傅里叶变换红外光谱仪测定RBC和FA-RBC的结构。
2.4 DOX-CS-NPs的制备与表征
采用离子交联法制备DOX-CS-NPs[13]。在25 ℃、400 r/min 的磁力搅拌下,于壳聚糖醋酸溶液(pH6.0)中加入DOX溶液,缓慢滴加三聚磷酸钠溶液至产生乳光,继续磁力搅拌10 min 得纳米粒混悬液;将纳米粒混悬液置于超滤管(100 kDa)中离心(4 000 r/min),即得DOX-CS-NPs。其中,DOX溶液、壳聚糖醋酸溶液、三聚磷酸钠溶液的质量浓度分别0.5、1.5、0.4 mg/mL,体积比为5 ∶5 ∶4。采用激光纳米粒径仪测定该纳米粒的粒径、多分散性指数(polydisepersity index,PDI)和Zeta电位。
2.5 DOX-CS-NPs包封率和载药量的测定
取适量DOX(质量记为M)按“2.4”项下方法制备纳米粒混悬液并超滤,取下清液,采用紫外可见分光光度计测定其中DOX 含量(记为M1)[14]。取超滤膜上纳米粒,冻干,称质量(记为M2)。计算包封率和载药量,具体公式如下:包封率(%)=(M-M1)/M×100%,载药量(%)=(M-M1)/M2×100%。
2.6 FA-RBC-DOX-CS-NPs的制备及表征
采用细胞破碎仪处理FA-RBC(功率100 W,先破碎4 s,间隔5 s 后,再破碎5 s),将破碎后的FA-RBC 和DOX-CS-NPs 经400 nm 聚碳酸酯膜挤压3 次后,再经200 nm 聚碳酸酯膜挤压5 次,即得FA-RBC-DOXCS-NPs。采用激光纳米粒径仪测定其粒径、PDI 和Zeta电位。
2.7 体外释放特性考察
分别取适量DOX、DOX-CS-NPs、FA-RBC-DOXCS-NPs 置于不同透析袋中,再将各透析袋分别置于pH7.4(模拟体循环环境)和pH6.5(模拟肿瘤微环境)的PBS溶液(释放介质)中,于37 ℃、100 r/min 摇床上进行透析。在预定的时间点(1、2、4、8、12、24、48、72 h),取出10 mL释放介质并补充等量新鲜介质,按“2.5”项下紫外分光光度法测定取出的释放介质中DOX的含量,并计算累积释放率。
2.8 体外抗肿瘤活性考察
取对数生长期的MCF-7 细胞,以1×104个/孔接种至96 孔板中,于37 ℃、5%CO2条件下培养24 h 后,弃去原培养基,分别加入含DOX、DOX-CS-NPs、FA-RBCDOX-CS-NPs 的培养基(以DOX计,质量浓度均分别为0.001、0.010、0.100、0.500、1.000、5.000 μ g/mL),每孔100 μL,各浓度平行5 份;另设对照组(只加细胞不加药物)。培养48 h 后,加入10 μL MTT(5 mg/mL),继续培养4 h;吸出培养基,加入DMSO 150 μL,采用酶标仪于570 nm波长处测定各孔光密度(optical density,OD)值,并计算细胞存活率,细胞存活率(%)=(给药组平均OD值/对照组平均OD值)×100%。
2.9 细胞摄取实验
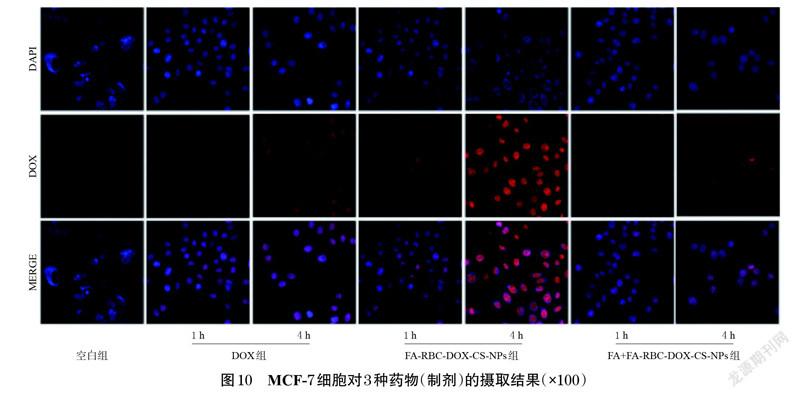
取对数生长期的MCF-7 细胞,以1×104个/孔接种至96 孔板中,于37 ℃、5%CO2条件下培养24 h 后,弃去原培养基,分别加入含DOX、FA-RBC-DOX-CS-NPs 和FA+FA-RBC-DOX-CS-NPs(游离FA用于封闭受体以验证纳米粒的入胞作用是否由FA受体介导)的新鲜培养基(以DOX计,质量浓度均为5 μg/mL);另設不加药物的空白组。于培养1、4 h 时移除培养基,以4%多聚甲醛固定30 min;以PBS 洗涤后,用10 μg/mL 的DAPI 染色1 h,采用共聚焦显微镜观察细胞的摄取情况。
3 结果与分析
3.1 FA-PEG2000-DSPE的合成结果
FA、NH2-PEG2000-DSPE 和FA-PEG2000-DSPE 的1H-NMR 如图2~ 图4 所示。对比图谱可知,图4 中7.73~7.55 ppm(e)和6.75~6.49 ppm(f)位置的2 个峰分别对应FA苯环上的H原子;8.11 ppm(d)和6.94 ppm(g)位置的2 个峰分别对应FA 上—NH—基团的H 原子;4.33 ppm(b)、4.49 ppm(h)、8.65 ppm(i)位置的峰也与FA的1H-NMR相符;3.51 ppm和1.24 ppm位置的峰分别属于NH2-PEG2000-DSPE 中—C17H35、—OCH2CH2— 基团上的H原子。由此表明,载体材料FA-PEG2000-DSPE合成成功。
3.2 FA修饰RBC的表征结果
傅里叶变换红外光谱仪检测结果(图5)显示,1 601.1 、1 451.4 cm-1为FA-RBC 中FA上苯环νC=C的骨架振动峰;3 294.8 cm-1归属于FA上的羟基;864.5 cm-1为FA苯环对位二取代的振动峰;1 156.1 cm-1为N—H振动峰。由此可知,FA已被成功修饰至RBC上。
3.3 DOX-CS-NPs的表征结果
DOX-CS-NPs 的载药量为(15.09±1.36)%,包封率为(60.99±0.92)%,平均粒径为(152.500±2.554)nm,PDI 为0.124±0.042,Zeta 电位为(10.100±0.216)mV,其中粒径分布和Zeta 电位见图6。由此可知,DOX-CSNPs的粒径较小、分布均匀。
3.4 FA-RBC-DOX-CS-NPs的表征结果
FA-RBC-DOX-CS-NPs 的平均粒径为(254.200 ±2.651)nm,PDI为0.199±0.031,Zeta 电位为(-10.100±0.213)mV,具体见图7。由于RBC 本身带负电,DOX-CS-NPs经FA-RBC包被后由带正电荷转变为带负电荷,由此可知,FA-RBC-DOX-CS-NPs 已被成功构建。
3.5 体外释放特性考察结果
由体外释放曲线(图8)可知,在2 种释放条件下,DOX 原药均释放最快,DOX-CS-NPs 次之,FA-RBCDOX-CS-NPs最慢。在pH7.4 的释放介质中,DOX在8 h左右释放完全,DOX-CS-NPs 在72 h 左右释放完全,FA-RBC-DOX-CS-NPs 在72 h 的累积释放率约为90%。在pH6.5 的释放介质中,这3 种药物(制剂)的释放速率均比在pH7.4 的释放介质中快,DOX在2 h 左右释放完全,DOX-CS-NPs 在12 h 内释放完全,FA-RBCDOX-CS-NPs 在36 h 内释放完全。由此可知,DOX-CSNPs和FA-RBC-DOX-CS-NPs 在模拟肿瘤微环境(pH6.5)中的释药速率均快于生理条件(pH7.4),这一特性可以减少药物在体循环中的释放,增加药物在肿瘤组织中的释放,从而减少副作用,增强药物抗肿瘤疗效。Evans 等[15]研究发现,在生理条件(pH7.4)下,红细胞发生溶血的概率不大,而肿瘤微环境(pH6.5)中,红细胞会出现强烈溶血。笔者推测这可能是FA-RBC-DOX-CSNPs在肿瘤微环境(pH6.5)中释放速率显著增加的原因之一。
3.6 体外抗肿瘤活性考察结果
DOX、DOX-CS-NPs、FA-RBC-DOX-CS-NPs 对MCF-7细胞增殖活力的影响见图9。由图9 可知,当DOX质量浓度在0.500~5.000 μg/mL 范围内,3 种药物(制剂)对MCF-7 细胞的抑制作用均呈浓度依赖趋势,MCF-7 细胞的增殖能力随着DOX质量浓度的升高而减弱。当DOX质量浓度在0.010~5.000 μg/mL 范围内时,DOX-CSNPs和FA-RBC-DOX-CS-NPs 对MCF-7 细胞的抑制效果不如DOX明显,这可能是由于上述2 种纳米制剂将药物包裹在纳米粒内,使其释放速率减慢,短时间内无法直接作用于肿瘤细胞。
3.7 细胞摄取实验结果
在体外抗肿瘤活性结果的基础上,为研究FA-RBCDOX-CS-NPs 对肿瘤细胞的靶向性和侵袭能力,考察了DOX 质量浓度为5 μg/mL 时,经DOX、FA-RBC-DOXCS-NPs和FA+FA-RBC-DOX-CS-NPs 處理1、4 h 后DOX的入胞行为,结果见图10。由图10 可知,处理1 h 后,3种药物(制剂)均被细胞摄取,但在细胞内的浓度均较低,且差别不大。处理4 h 后,细胞内3 种药物(制剂)的荧光强度均增强,表明细胞对DOX的摄取随作用时间的增加而增加;其中FA-RBC-DOX-CS-NPs 处理后的细胞的荧光强度最强,DOX次之,FA+FA-RBC-DOX-CS-NPs 最弱。由此可知,FA-RBC-DOX-CS-NPs 能主动识别肿瘤细胞表面的FA 受体并特异性结合,从而提高DOX的入胞效率。FA+FA-RBC-DOX-CS-NPs 处理细胞后,细胞表面受体被游离FA 封闭,无法靶向识别纳米粒,从而降低了DOX的入胞效率。
4 结语
本研究以DOX为模型药物,用壳聚糖和三聚磷酸钠采用离子交联法制备了DOX-CS-NPs,再用经FAPEG2000-DSPE 修饰后的RBC,构建得到FA-RBCDOX-CS-NPs。该纳米粒的平均粒径为(254.200 ±2.651)nm,PDI为0.199±0.031,Zeta 电位为(-10.100±0.213)mV。细胞实验结果也表明,该纳米粒对肿瘤细胞表面高表达的FA受体有明确的靶向性,能有效提高药物的入胞效率,实现肿瘤细胞内药物富集。
猜你喜欢 抗肿瘤 胡桃楸总鞣质的小鼠体内抗肿瘤作用研究中国医药导报(2017年3期)2017-03-21灵芝三萜化合物的抗肿瘤靶点预测与活性验证中国中药杂志(2017年3期)2017-03-20蒙药抗肿瘤机制研究概况中国民族民间医药·上半月(2017年1期)2017-02-21菜豆植物凝集素对肿瘤细胞增殖的抑制作用科教导刊(2016年26期)2016-11-15鸦胆子油剂型研究进展科技视界(2016年23期)2016-11-04茶叶提取物抗肿瘤作用的最新研究进展中国实用医药(2016年22期)2016-08-19黄芪抗肿瘤研究进展中国实用医药(2016年18期)2016-08-03大蒜素临床药理作用的研究进展科教导刊·电子版(2016年14期)2016-06-25BRAF激酶抑制剂的研究进展医学信息(2015年7期)2015-03-20抗肿瘤DNA疫苗的研究进展吉林农业·下半月(2014年4期)2014-06-27推荐访问:阿霉素 靶向 细胞膜推荐文章
- 【想移民荷兰的朋友看过来,告诉你定居荷兰是一种怎样的生活体验】荷兰移民需要什么条件
- [关于训练口才的经典句子]训练口才的经典句子
- 【加拿大留学金融系专业排名】 加拿大留学专业排名
- 2018年四川省人民医院神经外科临床医师编外人员招聘公告 2018年神经外科年会
- 2018安徽高考志愿填报及征集志愿时间安排:2018高考志愿填报征集志愿时间
- 行政前台工作计划表_行政前台工作计划怎么写
- 和女朋友表白感人的话_和女朋友表白的句子
- 【英语语法:the,fact,that的语法功能】 in fact等于什么
- [2018入党培训心得体会范文2000字【三篇】]入党积极分子思想汇报
- 2018年中级审计师考试试题每日一练(6.14)|审计师报名时间2018